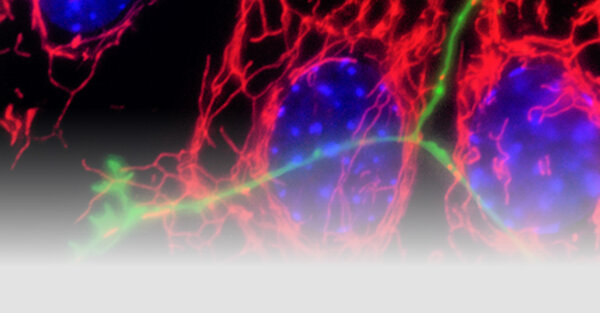
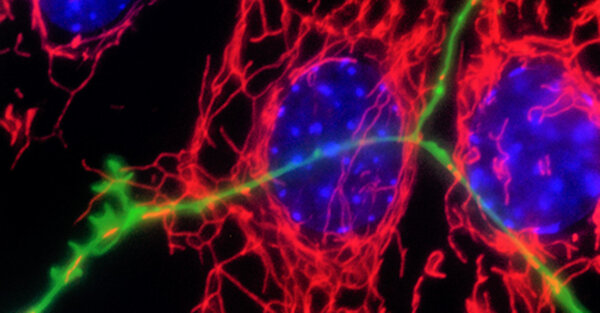
Neurodegenerative Erkrankungen sind bei einem Teil der Fälle mit genetischen Risiken und Genmutationen verbunden.Die überwiegende Mehrheit der Parkinson-Krankheitsfälle ist jedoch sporadisch und die Krankheit ist insgesamt heterogen in ihren Symptomen und ihrer Pathologie. Das Ziel der Forschungsgruppe Fitzgerald ist es, die molekularen Mechanismen der Neurodegeneration zu verstehen. Dafür werden genetische Formen der Krankheit als Ausgangspunkt verwendet und bisherige Erkenntnisse unter Verwendung von patientenabgeleiteten Biofluiden modelliert, um sporadische Fälle zu prognostizieren und/oder die Diagnose und/oder den Verlauf der Krankheit vorherzusagen.
Die Mitochondrien sind entscheidende Organelle, die Energie produzieren und viele andere zentrale Funktionen für den Stoffwechsel und die Zellsignalgebung übernehmen.Da Neuronen viel Energie verbrauchen, sind sie auf eine enge Kontrolle für bioenergetische Effizienz und mitochondriale Qualität angewiesen, indem sie die oxidative Belastung reduzieren. Mitochondriale Dysfunktion ist dabei ein Phänomen, das alle neurodegenerativen Erkrankungen teilen und die selektive Anfälligkeit bestimmter Neurone erklären kann. Dieses Phänomen ist bei der Parkinson-Krankheit besonders relevant. Die dopaminergen Neuronen degenerieren, weil die Mitochondrien eine Hauptquelle für oxidativen Stress und den Ort des Dopamin-Abbaus sind.
Eine große Anzahl an wissenschaftlichen Arbeiten hat die Rolle der mitochondrialen Dysfunktion bei bestimmten genetischen Formen der Parkinson-Krankheit dargestellt. Die genauen Mechanismen, die den sporadischen Formen der Krankheit zugrunde liegen, sind jedoch weniger klar definiert.
Wir nutzen verschiedene Modellzellensysteme mit einem Schwerpunkt auf patientenabgeleiteten Zellen. In enger Zusammenarbeit mit der Biobank des Hertie-Instituts und der Neurologischen Klinik arbeiten wir derzeit an primären menschlichen Fibroblasten, die von Patienten und Patientinnen und gesunden Personen abgeleitet sind, induzierten pluripotenten Stammzellen (iPSCs), neuronalen Vorläuferzellen (smNPCs) von kleinen Molekülen, reifen dopaminergen Neuronen und peripheren mononukleären Blutzellen (PBMCs) von Patienten und Patientinnen und gesunden Personen.
Wir führen hauptsächlich funktionale Arbeiten durch, die sich auf die Biologie, Biochemie und Physiologie konzentrieren.Dazu verwenden wir spezialisierte Techniken zur Überwachung der mitochondrialen Gesundheit, welche wir entwickelt haben. Wir nutzen unsere etablierten Techniken, einschließlich aber nicht beschränkt auf CRISPR-Gentechnik, Proteinbiochemie, Bildgebung und Durchflusszytometriemethoden.

PINK1 in der Parkinson-Krankheit
Molekulare Mechanismen im Zusammenhang mit der PINK1-Parkinson-Krankheit
Karan Sharma
Mutationen in der mitochondrialen PTEN-induzierten putativen Kinase 1 (PINK1) sind eine häufige Ursache für die rezessiv vererbte Parkinson-Krankheit. Die Mechanismen, durch die PINK1 zum Absterben dopaminerger Neuronen in der Substantia nigra führen kann, bleiben jedoch unklar. Um die Krankheit zu untersuchen, nutzen wir hauptsächlich in vitro kultivierte dopaminerge Neuronen aus humanen iPSCs. Neben der Beobachtung der "gut definierten" kanonischen Mitophagie-Störung nach einer mitochondrialen Membrandepolarisation beobachten wir metabolische Unterschiede in dopaminergen Neuronen mit PINK1-Verlust-funktion, die mit, aber nicht beschränkt auf die Mitochondrien, zusammenhängen. Durch vertiefende Untersuchungen mittels kollaborativer Multiomik-Ansätze, d. h. Phospho-/Proteomik und Lipidomik, und Verwendung dieser Datensätze als Referenz-Einstiegspunkt, haben wir 1. eine erhöhte Cholesterinbiosynthese identifiziert, die zu einem Anstieg von Cholesterin in PINK1-Knockout-dopaminergen Neuronen führt, und 2. PINK1 beeinflusst den Dopamin-Stoffwechsel über die Regulation der Tyrosin-Hydroxylase, des limitierenden Enzyms für die Dopamin-Synthese. In diesen Projekten zielen wir darauf ab, die molekularen Mechanismen zu untersuchen, durch die PINK1 diese veränderten Wege in dopaminergen Neuronen beeinflusst, in der Hoffnung, Therapeutika zu entwickeln, die zukünftig Patienten und Patientinnen mit Parkinson-Krankheit zugutekommen könnten.
Diese Studie wird von der Deutschen Forschungsgemeinschaft (DFG) im Rahmen des Graduiertenkollegs MOMbrane 654651/GRK2364 finanziert. MOMbrane zielt darauf ab, die verschiedenen Funktionen der mitochondrialen äußeren Membran (MOM) sowie ihre Struktur, Regulation und Biogenese zu untersuchen. MOMbrane umfasst zehn Promovierende an verschiedenen Instituten in Tübingen, die sich jeweils auf verschiedene Aspekte der MOM konzentrieren. Das Projekt wird in Zusammenarbeit mit Partnerlaboren am Weizmann-Institut in Rehovot (Israel) durchgeführt. Link zur Website des RTG MOMbrane: https://www.mombrane.de/
Die Rolle des mitochondrialen äußeren Membranproteins Miro1 in der Parkinson-Krankheit
Miro1-Funktion in dopaminergen Neuronen
Lisa Schwarz (Alumni)
Wir haben krankheitsassoziierte (RHOT1 R272Q) und funktionelle (RHOT1 S156A und K572R) Miro1/RHOT1-Mutationen in menschlichen iPSCs mittels Gentechnik eingeführt. Gesunde und bearbeitete iPSCs können dann in andere Zelltypen, einschließlich Neuronen, differenziert werden (Schwarz, Casadei und Fitzgerald, 2021). Wir haben die Funktion von Miro1 unter Verwendung dieser mutations- und wegebezogenen Mutationen untersucht, indem wir den mitochondrialen Umsatz, den Mitophagie-Stoffwechsel und die Calciumverarbeitung bewertet haben (Schwarz und Fitzgerald, 2022, Schwarz et al., 2022).
Diese Studie wird von der Deutschen Forschungsgemeinschaft (DFG) im Rahmen des Graduiertenkollegs MOMbrane 654651/GRK2364 finanziert. Link zur Website des RTG MOMbrane: https://www.mombrane.de/
Miro1-Retention an depolarisierten Mitochondrien bei der Parkinson-Krankheit
Layla Drwesh
Miro1 ist ein mitochondriales äußeres Membranprotein mit zwei atypischen GTPase-Domänen, die zwei zentrale EF-Hände (Calciumbindungsdomänen) umgeben. Seine Hauptfunktion besteht darin, die mitochondriale Bewegung entlang der Mikrotubuli zu erleichtern, indem es die Mitochondrien über Adapterproteine TRAK1/2 an molekulare Motoren anheftet. Der mitochondriale Transport ist für die ordnungsgemäße mitochondriale Verteilung für die neuronale Gesundheit notwendig. Neben der mitochondrialen Mobilität ist Miro1 stark in die mitochondriale Qualitätskontrolle verwickelt, da sein Abbau ein bekannter Marker für klassische CCCP-induzierte Mitophagie ist. Darüber hinaus interagiert Miro1 mit PINK1 (Weihofen et al., 2009) und Parkin (Birsa et al., 2014, Klosowiak et al., 2016), was es zu einem wichtigen Spieler in der PINK1-Parkin-vermittelten mitochondrialen Qualitätskontrolle macht. Miro1 wurde mit der PD-Biologie in Verbindung gebracht, nachdem entdeckt wurde, dass LRRK2 Miro1 durch Bildung eines Komplexes damit entfernt (Hsieh et al., 2016). In derselben Studie wurde erstmals unter Verwendung von humanen Fibroblasten von Patienten und Patientinnen gezeigt, dass Miro1-Abbau bei sporadischer PD beeinträchtigt ist, was zu einer verzögerten Mitophagie führt. Es ist jedoch immer noch unklar, warum bei einigen PD-Zellen nach einer mitochondrialen Depolarisation eine Miro1-Retention auftritt und bei anderen nicht. Um diese Lücke zu schließen und die Häufigkeit der Miro1-Retention bei PD besser zu verstehen, zielt diese Studie darauf ab, die Reaktion von Miro1 auf eine mitochondriale Depolarisation in einer unabhängigen Kohorte von PD-Patienten und Patientinnen und gesunden Kontrollprobanden und -probandinnen aus Tübingen zu messen. Für diese Untersuchung verwenden wir verfügbare Biomaterialien wie Fibroblasten und Blut. Durch die Validierung von Miro1 als robustem zellulärem Merkmal für PD wird diese Forschung zu therapeutischen Interventionen beitragen, die auf das Miro1-defekte Phänotyp bei PD-Patienten und Patientinnen abzielen.
Dieses Projekt wird von der Michael J. Fox Foundation finanziert. MJFF-021967.
BEST - Bewertung von Biomarkern zur Unterstützung der klinischen Translation bei Schizophrenie
Maria Zarani & Richard Wüst
Psychosen repräsentieren eine Gruppe von Krankheiten, die durch enorme Heterogenität gekennzeichnet sind. Als Folge davon sind Diagnose, Prognose und Behandlungsentscheidungen für einzelne Patienten und Patientinnen ziemlich herausfordernd. Im Rahmen des Projekts werden wir Biomarker-Signaturen von Patienten und Patientinnen mit hohem Risiko für Schizophrenie und mit definierten psychotischen Erkrankungen optimieren. Dies wird durch Integration multimodaler Patientendaten und anschließende Validierung der Biomarker-Signaturen mit Hilfe von patientenabgeleiteten Neuronen erreicht.
Das Projekt wird durch das BMBF (FRN: 01EK2101A) finanziert und in Zusammenarbeit mit vier Partnern durchgeführt: LMU München, ZI Mannheim, NMI Reutlingen und dem Hertie-Institut für klinische Hirnforschung/Universitätsklinik für Psychiatrie Tübingen (HIH/UKPP). Die Validierung von mitochondrialen Ausgaben wird vom HIH/UKPP durchgeführt.
Die Rolle des endosomalen-lysosomalen Systems bei atypischer Parkinson-Krankheit/Corticobasal-Syndrom
Katharina Stegen (Alumni), Lisa Schwarz (Alumni) und Julia Fitzgerald
Eine Dysfunktion des endosomalen-lysosomalen Systems ist ein Phänomen, das viele neurodegenerative Erkrankungen durchläuft, einschließlich Alzheimer-Krankheit, Parkinson-Krankheit und anderer seltenerer neurodegenerativer Erkrankungen wie progressiver supranukleärer Lähmung (PSP) und corticobasalem Syndrom/Degeneration (CBS/CBD). Das endosomale lysosomale System wird durch Veränderungen des pH-Werts gebildet und gesteuert, und daher sind die Ionaustauscher, die in den membranösen Kompartimenten des endosomalen Lumens vorhanden sind, entscheidend für die richtige pH-Regulierung. Diese Austauscher sind wichtig, und große Defekte führen oft zu schwerer geistiger Behinderung. Wir untersuchen Veränderungen im endolysosomalen System im Zusammenhang mit dem Natrium-Wasserstoff-Austauscher 6 (NHE6), die zur Anfälligkeit für die Entwicklung neurodegenerativer Erkrankungen im späteren Leben beitragen könnten.
Dieses Projekt wurde vom Fortüne-Programm der Medizinischen Fakultät der Universität Tübingen finanziert. Dieses Projekt wird in Zusammenarbeit mit Rejko Krüger (LCSB, Luxemburg und Luxemburgisches Institut für Gesundheit, Luxemburg) durchgeführt.
Mitochondriale DNA als Biomarker für die Parkinson-Krankheit
Julia Fitzgerald, Gerrit Machetanz, Anne Grünewald (LCSB, Université du Luxemburg)
Sporadische Formen der Parkinson-Krankheit sind am häufigsten, aber sie sind schwierig im Labor zu modellieren, da keine bekannte Genmutation vorhanden ist, die eingeführt oder korrigiert werden könnte, um isogene Kontrollen zu erzeugen. Statistisch gesehen werden große Kohorten benötigt, um gesunde Individuen mit sporadischen Parkinson-Krankheitspatienten und -patientinnen zu vergleichen. Dies stellt ein Problem dar, da die Kultur von patientenabgeleiteten Zelllinien für solche große Kohorten spezielle Robotik erfordert, invasiv für die Patienten und Patientinnen und auch teuer ist. Um dieses Problem zu überwinden, sammeln wir Bioflüssigkeiten aus einer großen Kohorte von Parkinson-Krankheitspatienten und -patientinnen, einschließlich sporadischer und familiärer Fälle, bei denen mitochondriale Proteine betroffen sind. Wir werden nach Veränderungen in den Mitochondrien in diesen Zellen suchen, um Subgruppen von Patienten und Patientinnen zu identifizieren, die in Zukunft von Medikamenten profitieren könnten, die auf die mitochondriale Dysfunktion abzielen.
Dieses Projekt wird von der Michael J. Fox Foundation finanziert. MJFF-15744, MJFF-021147

+49 (0)7071-
29-81971

2024
Sharma K, Kishore A, Lechado-Terradas A, Passannanti R, Raimondi F, Sturm M, Sreelatha AAK, Puthenveedu DK, Sarma G, Casadei N, Krüger R, Gasser T, Kahle P, Riess O, Fitzgerald JC, Sharma M. A Novel PINK1 p.F385S Loss-of-Function Mutation in an Indian Family with Parkinson's Disease. Mov Disord. 2024 Apr 8. doi: 10.1002/mds.29792. Epub ahead of print. PMID: 38586902.
2023
Breitmeyer R, Vogel S, Heider J, Hartmann SM, Wüst R, Keller AL, Binner A, Fitzgerald JC, Fallgatter AJ, Volkmer H. Regulation of synaptic connectivity in schizophrenia spectrum by mutual neuron-microglia interaction. Commun Biol. 2023 Apr 29;6(1):472. doi: 10.1038/s42003-023-04852-9. PMID: 37117634; PMCID: PMC10147621.
Schumacher L, Slimani R, Zizmare L, Ehlers J, Kleine Borgmann F, Fitzgerald JC, Fallier-Becker P, Beckmann A, Grißmer A, Meier C, El-Ayoubi A, Devraj K, Mittelbronn M, Trautwein C, Naumann U. TGF-Beta Modulates the Integrity of the Blood Brain Barrier In Vitro, and Is Associated with Metabolic Alterations in Pericytes. Biomedicines. 2023 Jan 14;11(1):214. doi: 10.3390/biomedicines11010214. PMID: 36672722; PMCID: PMC9855966.
2022
Lechado-Terradas A, Schepers S, Zittlau K, Sharma K, Ok O, Fitzgerald JC, Westermann GB, Macek B and Kahle PJ. (2022). Parkin-dependent mitophagy occurs via proteasome-dependent steps sequentially targeting separate mitochondrial sub-compartments for autophagy. AUTOPHAGY REPORTS, VOL. 1, NO. 1, 576–602. doi.org/10.1080/27694127.2022.2143214.
Schwarz L, Sharma K, Dodi LD, Rieder LS, Fallier-Becker P, Casadei N, Fitzgerald JC. Miro1 R272Q disrupts mitochondrial calcium handling and neurotransmitter uptake in dopaminergic neurons. Front Mol Neurosci. 2022 Dec 2;15:966209. doi: 10.3389/fnmol.2022.966209. PMID: 36533136; PMCID: PMC9757607.
Schmidt S, Luecken MD, Trümbach D, Hembach S, Niedermeier KM, Wenck N, Pflügler K, Stautner C, Böttcher A, Lickert H, Ramirez-Suastegui C, Ahmad R, Ziller MJ, Fitzgerald JC, Ruf V, van de Berg WDJ, Jonker AJ, Gasser T, Winner B, Winkler J, Vogt Weisenhorn DM, Giesert F, Theis FJ & Wurst W. Primary cilia and SHH signaling impairments in human and mouse models of Parkinson’s disease. /Nat Commun/ 2022; 13, 4819 PMID: 35974013
Arena G, Sharma K, Agyeah G, Krüger R, Grünewald A, Fitzgerald JC. Neurodegeneration and Neuroinflammation in Parkinson's Disease: a Self-Sustained Loop /Curr Neurol Neurosci Rep/ 2022; June 8:1–14 PMID: 35674870
Harmuth T, Weber JJ, Zimmer AJ, Sowa AS, Schmidt J, Fitzgerald JC, Schöls L, Riess O, Hübener-Schmid J. Mitochondrial Dysfunction in Spinocerebellar Ataxia Type 3 Is Linked to VDAC1 Deubiquitination /Int. J. Mol. Sci/ 2022; 23, 5933 PMID: 35682609
Schwarz L and Fitzgerald JC. Steady-State Levels of Miro1 Linked to Phosphorylation at Serine 156 and Mitochondrial Respiration in Dopaminergic Neurons /Cells/ 2022; 11, no. 8: 1269. PMID:35455950
Kakade P, Ojha H, Raimi OG, Kakade P, Ojha H, Raimi OG, Shaw A, Waddell AD, Ault JR, Burel S, Brockmann K, Kumar A, Ahangar MS, Krysztofinska EM, Macartney T, Bayliss R, Fitzgerald JC, Muqit MMK. Mapping of a N-terminal α-helix domain required for human PINK1 stabilization, Serine228 autophosphorylation and activation in cells. /Open Biol./ 2022;12(1):210264 PMID: 35042401
2021
Schwarz L, Casadei N and Fitzgerald JC. Generation of R272Q, S156A and K572R RHOT1/Miro1 point mutations in iPSCs from a healthy individual using FACS-assisted CRISPR/Cas9 genome editing. /Stem Cell Res./ 2021 25(55), 102469. PMID: 34359002
Brown SJ, Boussaad I, Jazaro J, Fitzgerald JC, Antony P, Keatinge M, Blechman, J, Schwamborn J, Krüger R, Placzek M, Bandmann O. PINK1 deficiency impairs adult neurogenesis of dopaminergic neurons. /Sci Rep/ 2021; 11, 6617. PMID: 33758225
Körner A, Bernard A, Fitzgerald JC, Alarcon-Barrerer JC, Kostidis S, Kaussen T, Giera M & Mirakaj V. Sema7A is crucial for resolution of severe inflammation. /PNAS/ 2021; 118, e2017527118. PMID: 33637648
2020
Bus C, Zizmare L, Feldkaemper M, Geisler S, Zarani M, Schaedler A, Klose F, Admard, J, Mageean CJ, Arena J, Fallier-Becker P, Ugun-Klusek A, Maruszczak K, Kapolou K, Schmid B, Rapaport D, Ueffing M, Casadei N, Krüger R, Gasser T, Vogt-Weisenhorn D, Kahle PJ, Trautwein C, Gloeckner CJ and Fitzgerald JC. Human Dopaminergic Neurons Lacking PINK1 Exhibit Disrupted Dopamine Metabolism Related to Vitamin B6 Co-Factors./iScience/ 2020; 23, 12, 101797. PMID: 33299968
Stock R, Jeckel P, Kraushaar U, Wüst R, Fallgatter A, Volkmer H. The potential of induced pluripotent stem cells for discriminating neurodevelopmental disorders. Stem Cells Transl Med. 2021 Jan;10(1):50-56. doi: 10.1002/sctm.20-0206. Epub 2020 Aug 31. PMID: 32864861; PMCID: PMC7780807.
Stock R, Vogel S, Mau-Holzmann UA, Kriebel M, Wüst R, Fallgatter AJ, Volkmer H. Generation and characterization of human induced pluripotent stem cells lines from four patients diagnosed with schizophrenia and one healthy control. Stem Cell Res. 2020 Oct;48:101961. doi: 10.1016/j.scr.2020.101961. Epub 2020 Aug 27. PMID: 32911325.
2019
Hertlein V, Flores-Romero H, Das KK, Fischer S, Heunemann M, Calleja-Felipe M, Knafo S, Hipp K, Harter K, Fitzgerald JC, García-Sáez AJ. MERLIN: a novel BRET-based proximity biosensor for studying mitochondria-ER contact sites. /Life Sci Alliance/ 2019; Dec 9;3(1). PMID: 31818884
Grossmann D, Berenguer-Escuder C, Bellet M, Scheibner D, Bohler J, Massart F, Rapaport D, Skupin A, Fouquier d'Hérouël A, Sharma M, Ghelfi J, Raković A, Lichtner P, Antony P, Glaab E, May P, Dimmer K, Fitzgerald JC, Grünewald A, Krüger R. Mutations in RHOT1 Disrupt Endoplasmic Reticulum-Mitochondria Contact Sites Interfering with Calcium Homeostasis and Mitochondrial Dynamics in Parkinson's Disease. /Antioxid Redox Signal/ 2019; Dec 1;31(16):1213-1234. PMID: 31303019
2018
Ugun-Klusek A, Theodosi TS, Fitzgerald JC, Burté F, Ufer C, Boocock D, Yu-Wai-Man P, Bedford L, Billett EE. Monoamineoxidase-A promotes protective autophagy in human SH-SY5Y neuroblastoma cells through Bcl-2 phosphorylation. /Redox Biol./2018; 20,167-181.PMID: 30336354
Jores T, Lawatscheck J, Beke V, Franz-Wachtel M, Yunoki K, Fitzgerald JC, Macek B, Endo T, Kalbacher H, Buchner J, and Rapaport D. Cytosolic Hsp70 and Hsp40 chaperones enable the biogenesis of mitochondrial β-barrel proteins. /J. Cell. Biol./2018; Sep 3;217(9):3091-3108. PMID: 29930205
Fitzgerald JC, Zimprich A, Bobbili DR, May P, Sharma M, Krüger R. Reply: No evidence for rare TRAP1 mutations influencing the risk of idiopathic Parkinson’s disease. /Brain/ 2018; 141 (3):17. PMID: 29373630 * corresponding author
Sofi S, Fitzgerald JC, Jähn D, Dumoulin B, Stehling S, Kuhn H, Ufer C. Functional characterization of naturally occurring genetic variations of the human Guanine-rich RNA sequence binding factor 1 (GRSF1). /Biochim. Biophys. Acta/. 2018;1862(4):866-876. PMID: 29366917
Marrone L, Bus C, Schöndorf D, Fitzgerald JC, Kübler M, et al. Generation of iPSCs carrying a common LRRK2 risk allele for in vitro modeling of idiopathic Parkinson's disease. /PLOS One/2018; 13(3). PMID: 29513666
Rotermund C, Machetanz G, Fitzgerald JC. The Therapeutic Potential of Metformin in Neurodegenerative Diseases. /Frontiers in Endocrinology/ 2018; 19;9:400. PMID:
- Herzlich willkommen an unseren neuen MSc-Abschlussstudenten Joschua Eberhart (Graduate Training Centre of Neuroscience, Tübingen), der an der Charakterisierung von CRISPR/Cas9-geneeditierten iPSC für Screening arbeiten wird.
- Herzlich willkommen an unsere neue Doktorandin und RTG MOMbrane-Stipendiatin Rusheka Maxwell, die in diesem Sommer beginnen wird.
- Für weitere Neuigkeiten und Ankündigungen von MOMbrane besuchen Sie bitte www.mombrane.de
- Derzeit sind wir damit beschäftigt, Studierende und Praktikanten und Praktikantinnen auszubilden, und haben bereits alle Studierendenprojekte bis 2025 vereinbart. Daher haben wir keine weiteren Möglichkeiten für Postdocs, PhD-, MSc-, BSc-Projekte oder Praktika.

Hertie-Zentrum für Neurologie
Hertie-Institut für klinische Hirnforschung
Abteilung Neurologie mit Schwerpunkt neurodegenerative Erkrankungen
Otfried Mueller Strasse 27
72076 Tuebingen
Tel.: +49 (0)7071 29 81971
Fax: +49 (0)7071 29-4255












